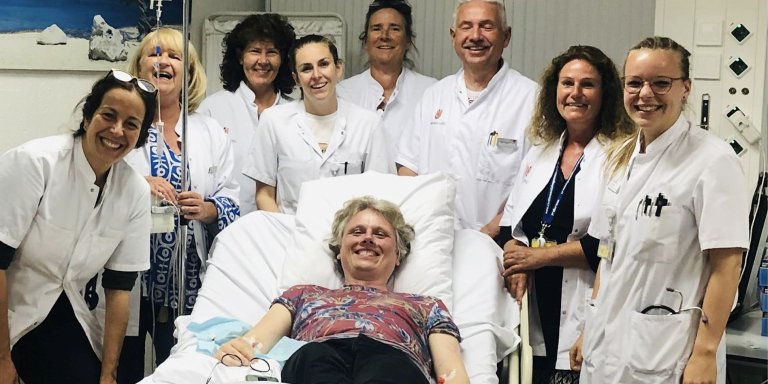
“Deze HAE-patiënt is al jarenlang bij ons bekend”, vertelt Danny Cohn. “In zijn familie komt deze erfelijke aandoening bij diverse familieleden voor; voor hem een extra motivatie om mee te doen aan dit onderzoek. Al ruim een jaar keek hij hiernaar uit; hij is iemand die de ontwikkelingen op de voet volgt en actief is in de patiëntenvereniging.” Cohn heeft de behandeling via een videoverbinding vanaf Bonaire van uur tot uur gevolgd en begeleid. “Via het infuus werd de CRISPR-Cas9-therapie toegediend; het medicijn wordt opgenomen in de lever, waar het de aanmaak van een eiwit onderdrukt.”
Leven weer terugkrijgen
Hereditair angio-oedeem is een zeldzame erfelijke aandoening, veroorzaakt door een tekort aan het eiwit C1-esteraseremmer. Als deze remmer ontbreekt, krijgt het zogeheten boodschapper-eiwit kallikreine vrij spel. En daardoor kunnen op allerlei plekken in het lichaam plotselinge zwellingen ontstaan. Dat klinkt wellicht onschuldiger dan het is, legt Cohn uit: “Toen ik vijf jaar geleden behandelaar werd, zag ik hoe deze aandoening het leven kan beheersen van patiënten, terwijl ze doorgaans verder helemaal gezond zijn. Dat motiveerde me om op zoek te gaan naar betere behandelingen. Als deze behandeling aanslaat, hebben zij hun leven weer terug."
Internationaal expertisecentrum
Amsterdam UMC huisvest het internationale expertisecentrum (van de European Reference Networks voor zeldzame erfelijke aandoeningen) en is daarmee ook het landelijke referentiecentrum van HAE. “Er zijn hier ruim 100 HAE-patiënten in behandeling”, zegt Cohn. De mate waarin ze ziek zijn, verschilt. De zwellingen zijn in het beste geval slechts ontsierend, in het ergste geval zijn ze invaliderend, pijnlijk of levensbedreigend. “Patiënten kunnen gebukt gaan onder uiterst hevige buikpijnen, waar ze dagenlang hondsberoerd van zijn”, illustreert hij. “En als het een zwelling aan de luchtwegen betreft, kan het zelfs leiden tot verstikking.”
DNA-‘schaartje’
Tot nu toe konden aanvallen alleen tijdelijk onderdrukt worden met medicijnen. CRISPR-Cas9 brengt daar verandering in. Om uit te leggen hoe het werkt, trekt Cohn een vergelijking met het luchtalarm dat we elke eerste maandag van de maand horen. “Stel je voor dat het luchtalarm door een storing om de haverklap afgaat en het niet lukt om de hoofdinstallatie uit te zetten. Dan zou je er wel voor kunnen zorgen dat de lokale speakers het geluidssignaal van de hoofdinstallatie niet meer kunnen uitzenden. CRISPR-Cas9 onderdrukt de aanmaak van een belangrijk boodschapper-eiwit (prekallikreïne), zodat het signaal dat leidt tot zwellingen niet meer kan worden doorgegeven.”
In cellen werkt CRISPR-Cas9 als een schaartje, dat een stukje verkeerd DNA weg kan knippen. Oorspronkelijk is dat ‘schaartje’ een verdedigingsmechanisme van een bacterie, die zich daarmee tegen virussen wapent. Zodra het virus de bacterie binnendringt, knipt de bacterie het virus-DNA stuk. Cohn: “Dat werkt dus ook in mensen. Het knippen kan simpel gezegd op twee manieren: een stukje verkeerd DNA er tussenuit knippen en weglaten, of het vervangen door gezond DNA. Wij doen het eerste, dat heet ‘loss of function’.”
De juiste dosis
Danny Cohn volgde de behandeling die zijn collega-onderzoekers Lauré Fijen en Daniela Stols-Gonçalves met de verpleegkundigen uitvoerden van uur tot uur via een videoverbinding. “Hij was wereldwijd de vijfde patient, in Nieuw Zeeland zijn vlak daarvoor de eerste vier mensen behandeld. De eerste drie kregen een lagere dosis. Dit is namelijk fase 1 van het geneesmiddelenonderzoek, waarin wordt gekeken welke dosis veilig en effectief is. Bij de eerste drie ging het goed, vervolgens krijgen drie mensen een hogere dosis, onder wie onze patiënt. We verwachten vooralsnog dat dit de juiste dosis is.” In volgende onderzoeksfases wordt gekeken of de vastgestelde dosis ook bij grotere groepen patiënten goed werkt. Daarna volgt nog een derde fase en vervolgens het registratietraject. Wanneer de behandeling voor alle patiënten met een ernstige vorm van HAE beschikbaar komt, is dus nog onbekend.
Genezing
Voorlopig is het afwachten of deze behandeling patiënten - zoals de onderzoekers hopen en eigenlijk ook verwachten - inderdaad volledig geneest. Eerder dit jaar rapporteerde Cohn’s onderzoeksgroep al in deNew England Journal of Medicine dat een tijdelijke onderdrukking van het boodschappereiwit leidt tot een drastische daling van aanvallen. Cohn: “Door dit eiwit nog dieper én permanent te onderdrukken met CRISPR-Cas9, ligt genezing nu binnen handbereik."
Foto: Nanet Sons
Tekst: Marleen Kamminga