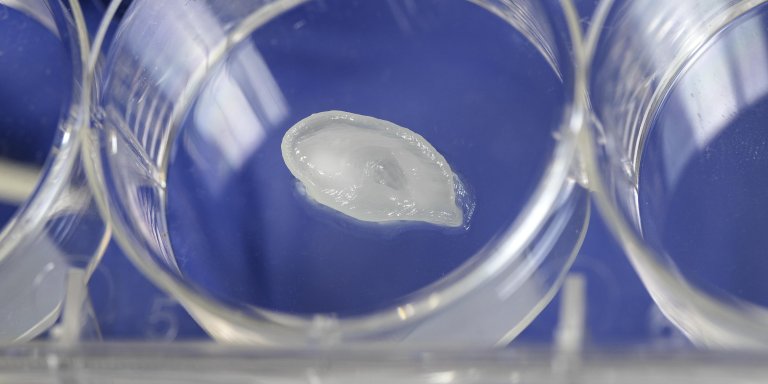
Het oor moet wel zo’n beetje het summum zijn van een gecompliceerde, driedimensionale structuur. In ieder geval is het de vorm die door medische onderzoekers over de hele wereld tevoorschijn wordt getoverd als zij hun kunsten met een 3D-printer willen vertonen. Ook in het laboratorium van hoogleraar Moleculaire genetica Arthur Bergen is het een van de eerste objecten die postdoctoraal onderzoeker Eszter Emri produceert tijdens de demonstratie van hun nieuwe 3D-printer. Na de nodige subtiele bewegingen van de printerkop ligt daar in een petrischaaltje onmiskenbaar een klein, wit oortje te glanzen.
Toch zit hem de kneep van deze demo niet in de gecompliceerde vorm, bezweert Emri. “Dit oortje hebben we geprint op basis van doodgewone Nivea-crème”, zegt zij niet zonder trots. “Niet zozeer de vorm, maar het zachte basismateriaal is hier de kunst. Hoe voorkom je dat vloeibaar materiaal uit de printer meteen wegloopt? Hoe laat je het water waarmee je sommige materialen vloeibaar maakt op het juiste moment verdampen? Dat zijn de vragen waarmee wij ons bezighouden bij het 3D-printen”, vertelt moleculair bioloog Emri.

Stamcellen als inkt
Het Nivea-oortje mag dan leuk zijn voor het bezoek, de eigenlijke vormen waar Emri dag in dag uit mee worstelt, zijn ogenschijnlijk simpele lijnen. “De ‘inkt’ van deze 3D-printer kan sinds enige tijd bestaan uit stamcellen”, vertelt ze. “Een tweede vernieuwing die het 3D-printen van levende materialen mogelijk heeft gemaakt, is de ongekende resolutie. We kunnen de cellen met een precisie van een paar micrometer op de juiste plek leggen. Die cellen printen we op een matrix, een soort mal van bijvoorbeeld oplosbare kunststof, of later misschien kraakbeencellen. Vervolgens moeten de stamcellen in een stoof uitgroeien tot het gewenste celtype.”
Structuren printen voor medicijnonderzoek
Tot zover de theorie van het moderne 3D-printen van levende weefsels. De praktijk blijkt nog razend weerbarstig. Emri: “We zijn een van de weinigen op de wereld met zo’n hypermoderne 3D-printer in het lab. Als we tegen problemen aanlopen, dan is er geen instructieboekje waar we op terug kunnen vallen, laat staan een helpdesk van de fabrikant. We hebben wel een nuttige gebruikersgroep. Samen met de andere gebruikers, waar ook ter wereld, proberen we uit te vinden hoe we bepaalde structuren kunnen printen, hoe we dat probleem van het gecontroleerd verdampen van water en alle andere praktische hobbels kunnen oplossen.”

Het hoofd van de sectie , hoogleraar Bergen, kijkt ondertussen een stap verder. Samen met Amsterdam UMC-hoogleraar Translationele regeneratieve geneeskunde Theo Smit, heeft hij een groot project opgetuigd rond de 3D-printer. “3D-printers in de geneeskunde hebben een enorme potentie”, zegt Bergen. “Levende weefsels uit de 3D-printer kunnen ons fundamentele onderzoek verder helpen. We kunnen ook goede, gestandaardiseerde structuren printen om medicijnonderzoek mee te doen en uiteindelijk zouden we zelfs transplanteerbare weefsels kunnen maken.”
Maculadegeneratie
Ook aan die praktische toepassingen werkt Emri inmiddels. Zo probeert de onderzoekster zogeheten ‘drusen’ te printen. Dat zijn structuren die in het oog kunnen ontstaan bij leeftijd-gerelateerde maculadegeneratie, AMD. Ze zijn enigszins vergelijkbaar met de plaques die bloedvaten kunnen blokkeren bij aderverkalking.
Bergen: “Maculadegeneratie is een oogaandoening die 4 procent van de mensen boven de 60 treft en zelfs 12 procent van de mensen boven de 70. Door de drusen die tussen de toplaag, het epitheel en de membraan van het netvlies gaan zitten, verliezen mensen langzaam hun zicht. Deze ‘leeftijd-gerelateerde blindheid’ is een invaliderende aandoening, die langzaam voortschrijdt en waartegen bovendien geen goede behandeling bestaat. Het ontstaan van maculadegeneratie ligt deels vast in genen, maar is ook een gevolg van een niet-gezonde leefstijl (roken). Het onderzoek naar de ziekte is lastig, bijvoorbeeld omdat proefdiermodellen zoals muizen geen macula of ‘gele vlek’ in hun netvlies hebben zoals wij.” Om het voortschrijden van de blindheid in de gele vlek beter te begrijpen, wil Bergen eerst het ontstaan en groeien van die drusen begrijpen. “Pas als je snapt hoe die structuren zich vormen, kun je rationeel nadenken over een (preventieve) behandeling.”
Voordat preventie van AMD in beeld komt, gloort er een andere oplossing. “Er wordt nu al gewerkt aan het printen van stukjes netvlies om de beschadigde delen te vervangen”, vertelt hoogleraar Smit. “Op basis van stamcellen van de patiënt zelf, is het mogelijk om zowel het epitheel, als de onderliggende netvliescellen te printen. In Amerika hebben collega’s al toestemming gekregen van de Food and Drug Administration om geprinte stukjes netvlies terug te plaatsen in proefdieren. Deze toepassing is een stuk minder futuristisch dan je misschien denkt.”
Tekst: Rob Buiter
Foto’s: Marieke de Lorijn